Krystallografi, gren av naturvitenskapen som omfatter læren om krystallene, deres vekst, ytre former (krystallgeometri), indre oppbygning (røntgenkrystallografi og krystallstruktur) og fysiske egenskaper (krystallfysikk og krystalloptikk).
Krystaller er bygd opp av atomer, ioner eller molekyler som er ordnet i en enhetscelle som repeteres krystallinsk, altså i tre dimensjoner. Repetisjonsmønsteret av en gitt, romlig atomordning kalles et romgitter eller translasjonsgitter.
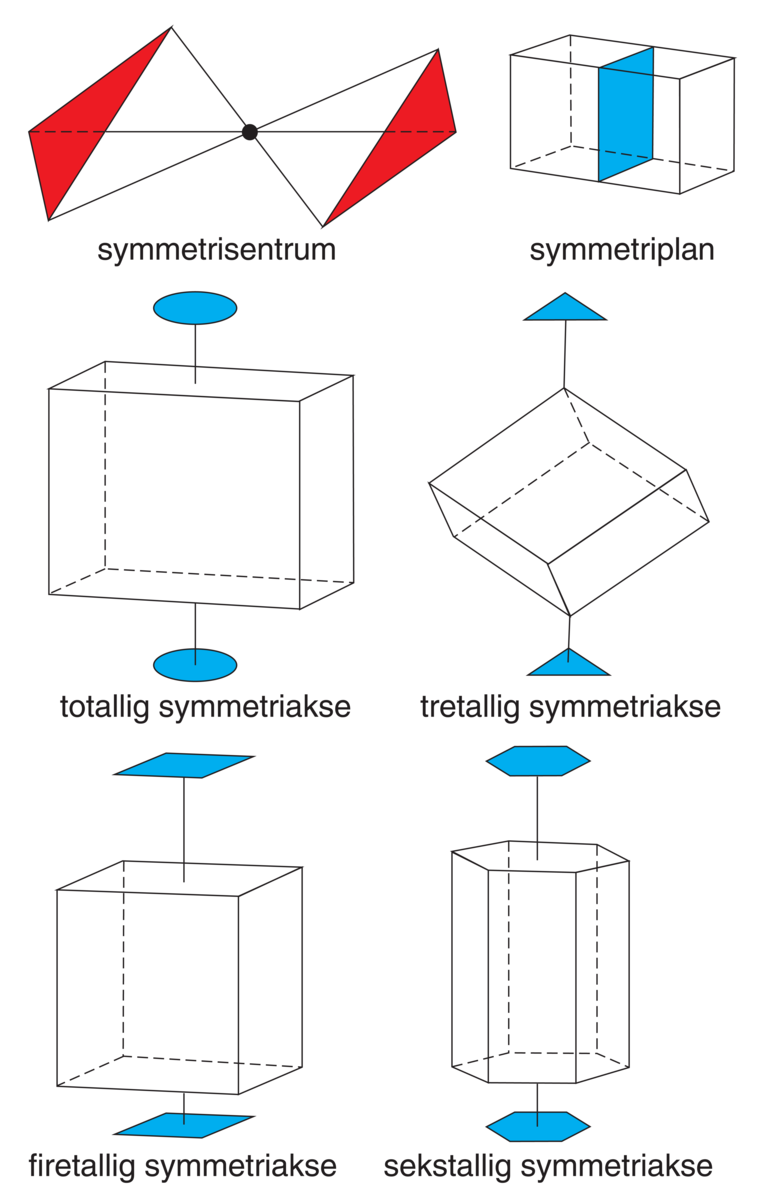
Det finnes 14 prinsipielt forskjellige romgittere (bravaisgittere), først oppstilt av Auguste Bravais i 1850. Teorien viser videre at det er 230 prinsipielt forskjellige måter å innpasse symmetri-operasjoner på for å beskrive ordningen av atomer innenfor de 14 romgitterne. Dette svarer til de 230 romgrupper som ble utledet av A. M. Schoenflies, E. S. Fedorov og W. Barlow uavhengig av hverandre omkring 1890. Etter sine symmetriegenskaper fordeler romgruppene seg på 32 krystallografiske punktgrupper. Disse vil gi uttrykk for krystallenes ytre symmetri. For å beskrive symmetrien til isolerte objekter (molekyler) benyttes operasjoner som symmetrisentrum, symmetriplan (speilplan), og symmetriakser (rotasjonsakser) som i krystallinske stoffer bare kan være to-, tre-, fire- eller sekstallige (se figuren).
For å beskrive fullstendig en krystalls symmetri som uttrykt i romgruppene, må to symmetrielementer, glidespeilplan og skrueakser, som innebærer translasjon, betraktes i tillegg. Punkt- og romgruppene er fordelt på 7 krystallsystemer. Disse er karakterisert ved spesielle aksekors, som illustrerer lengde og vinkel mellom kantene i enhetscellen.
Tidlige studier av krystaller fokuserte på deres ytre geometri. Ifølge vinkelkonstansloven, funnet av N. Steno i 1669, er vinkelen mellom ensbeliggende flater på krystaller av samme art konstant. Flatenes innbyrdes retninger er altså fast for en og samme krystallart. Størrelsesforholdet mellom flatene er avhengig av betingelsene under krystallveksten. Renè Just Haüy beskrev i 1801 loven om de rasjonale akseavsnitt, også kalt krystallgeometriens grunnlov (se indices).
Krystallenes ytre geometri reflekterer til dels symmetrien til atomarrangementet og bindingsforhold mellom atomene i krystallen. Informasjon om symmetriforhold fås normalt fra røntgendiffraksjon. Optisk mikroskopi av tynne slip benyttes ennå til karakterisering av mineraler. Visse fysikalske egenskaper er direkte avhengig av symmetriforholdene for materialet, for eksempel optisk aktivitet, eksistens av dipolmomenter i molekyler, ferro-, piezo- og pyroelektrisitet, med mer.
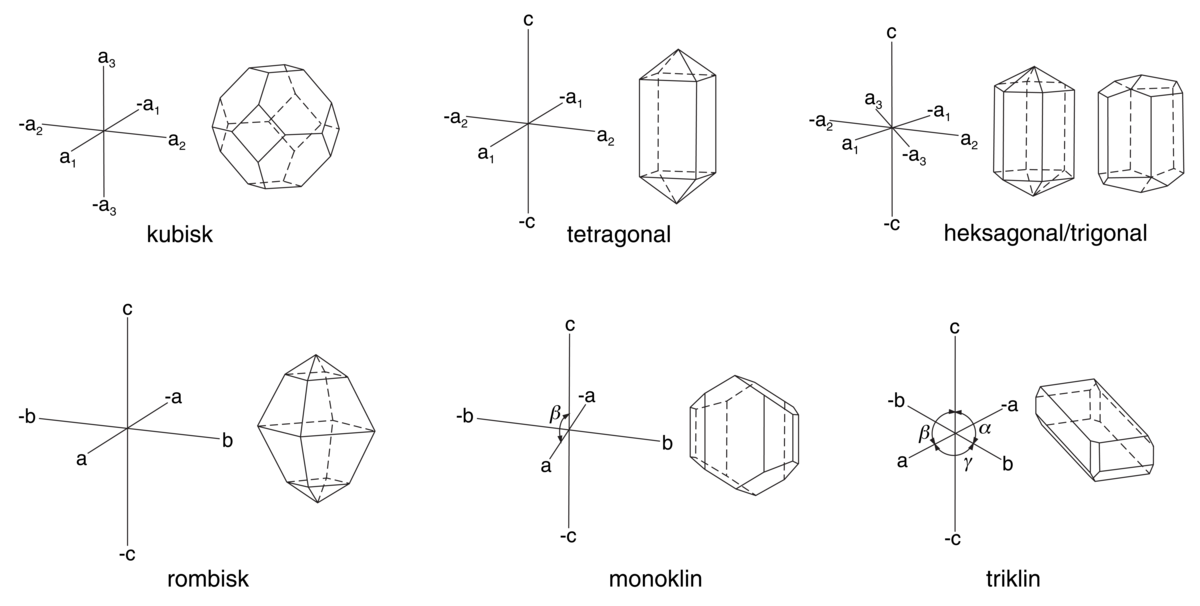
De forskjellige krystallsystemenes aksekors med eksempler på krystallformer fra hvert system. Kubiske (regulære, isometriske) system, tre like lange akser som står loddrett på hverandre. Krystallen viser en kombinasjon av oktaeder og kubus (terning). Tetragonale system, tre akser som står loddrett på hverandre og hvorav to er like lange (a1 og a2). Krystallen viser en kombinasjon av et prisme og en bipyramide. Heksagonale og trigonale system, en hovedakse c står loddrett på tre like lange akser a1, a2 og a3, som danner en vinkel på 120° med hverandre. Den venstre krystallen viser sekstallig symmetri (heksagonal) og den høyre krystallen tretallig symmetri (trigonal). Rombiske system med tre akser med ulike lengder som står loddrett på hverandre. Som eksempel er vist en rombisk krystall av svovel.Monokline system med tre akser med ulike lengder og en skjev vinkel β mellom a og c. Eksempel: monoklin krystall av et pyroksen-mineral. Trikline system, tre ulike lange akser som danner skjeve vinkler med hverandre. Eksempel: triklin krystall av mineralet rhodonitt.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.