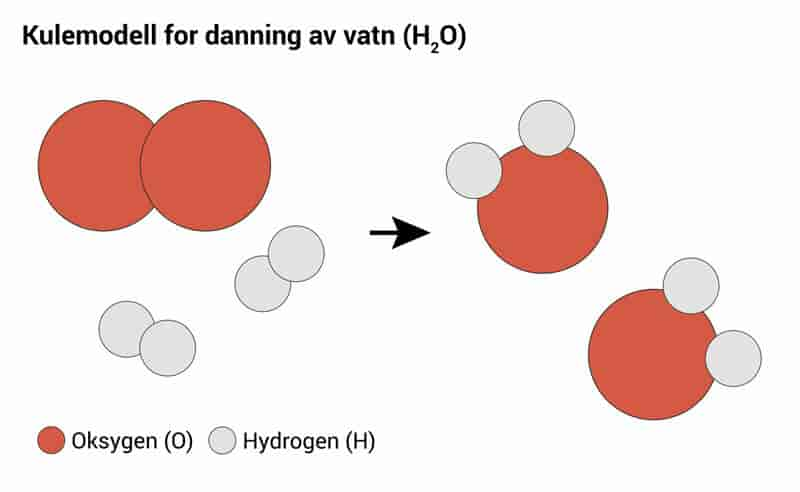
Kjemisk reaksjon er ein prosess der eitt eller fleire kjemiske stoff reagerer og dannar nye stoff. Alle stoff er bygde opp av atom som er bundne saman ved hjelp av ulike typar bindingar. Når desse bindingane blir brotne og sette saman på nye måtar, har det skjedd ein kjemisk reaksjon.
Faktaboks
- Uttale
- reaksjˈon
- Etymologi
- til reagere
I ein kjemisk reaksjon vil eitt eller fleire stoff (utgangsstoff) bli gjorde om til eitt eller fleire nye stoff (produkt). Det nye stoffet vil vere bygd opp på ein annan måte enn den stoffet vi hadde i utgangspunktet. Molekylet eller saltet får ein annan kjemisk struktur. Utgangsstoffa og produkta vil dessutan ha ulike kjemiske eigenskapar.




Kommentarar
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.